| (15) |
Para la distribución de Maxwell Boltzmann se especificaba que la mayoría de los estados de partículas simples esten vacíos y pocos contengan una molécula y es mucho menor donde hay más de una molécula.
Partiendo de la probabilidad de que una molécula esté en un estado de energía cinética dada de acuerdo a la distribución es:
| (15) |
donde obtenemos que el número promedio de moléculas que se
encuentran en el estado traslacional ![]() con momentum respectivo
con momentum respectivo ![]()
| (16) |
la condición clásica se cumple si ![]() es muy pequeño
es muy pequeño
![]() porque así los estados se encuentran en mayoría
desocupados o con una molécula lo más. Esta condición se
transforma en:
porque así los estados se encuentran en mayoría
desocupados o con una molécula lo más. Esta condición se
transforma en:
condición suficiente para la validez del régimen. También es
claro que a temperaturas altas (Kelvin) y bajas densidades la
distribución se ajusta mejor, de manera que la ![]() del
gas ideal se mantiene. Para interpretar la condición del régimen
clásico es necesario recurrir a ciertos conceptos de mecánica
cuántica. Partiendo de que una partícula tiene un momentum
del
gas ideal se mantiene. Para interpretar la condición del régimen
clásico es necesario recurrir a ciertos conceptos de mecánica
cuántica. Partiendo de que una partícula tiene un momentum ![]() asociado con la longitud de onda de de Broglie
asociado con la longitud de onda de de Broglie
| (18) |
recordando el resultado obtenido para energía cinética media de las partículas
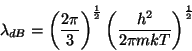 |
(19) |
donde es claro que la introducción del factor ![]() obedece a la
conveniencia de escribirlo así para encontrar el factor de
obedece a la
conveniencia de escribirlo así para encontrar el factor de ![]() , sustituyendo este resultado en dicha ecuación encontramos que:
, sustituyendo este resultado en dicha ecuación encontramos que:
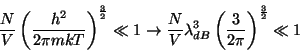 |
(20) |
y recordando que la distancia media entre moléculas es
![]() y nuevamente haciendo las
sustituciones del caso
y nuevamente haciendo las
sustituciones del caso
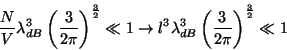 |
(21) |
en esta relación el factor
![]() es
una constante por tanto la relación entre las variables es
es
una constante por tanto la relación entre las variables es
| (22) |
que reformulando la condición en ![]() se establece que
la longitud de onda de de Broglie debe ser pequeña comparada con la
separación entre moléculas. Esto es evidente para evitar los efectos
de interferencia entre las ondas de de Broglie para distintas
partículas. Esto concuerda con la derivación para la
distribución de Maxwell Boltzmann (caso clásico) donde las
partícualas obedecen la mecánica Newtoniana. Sin embargo, cuando
se establece que
la longitud de onda de de Broglie debe ser pequeña comparada con la
separación entre moléculas. Esto es evidente para evitar los efectos
de interferencia entre las ondas de de Broglie para distintas
partículas. Esto concuerda con la derivación para la
distribución de Maxwell Boltzmann (caso clásico) donde las
partícualas obedecen la mecánica Newtoniana. Sin embargo, cuando
![]() es comparable con
es comparable con ![]() estos efectos son apreciables la
distribución no describe el fenómeno de manera aceptable y es
necesario utilizar la mecánica cuántica.
estos efectos son apreciables la
distribución no describe el fenómeno de manera aceptable y es
necesario utilizar la mecánica cuántica.